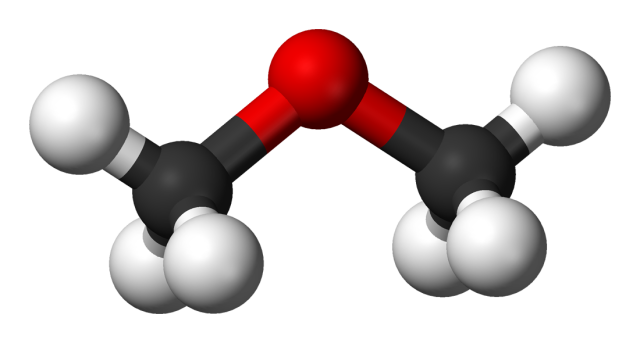
Gero eta arreta gehiago eskaintzen ari zaio dimetil eterrari (DME, CH3-O-CH3), aplikazio anitzeko konposatua delako, eta petrolioaren ordezko energia-iturrietatik (ikatza, gas naturala eta biomasatik) ekoitzi daitekeelako.
DME gas propultsatzaile eta hoztaile bezala erabiltzen da. Gainera, epe ertainera dieselaren edo petrolioaren gas likidotuen (propanoa eta butanoaren) ordezko erregaia izan liteke. Badira hainbat arrazoi: bere zetano indize altua (diesel erregaiaren sutzearen kalitatea adierazten duena), errekuntzan isuritako CO, NOx, SOx eta hidrokarburoen kantitate baxuak, ke ekoizpenik eza, eta motorraren zarata baxuagoa, diesel erregaiarekin alderatuta. Ondorioz, DMEren erregai-erabilera diesel ibilgailuen erabilera sustatzeko bidea da. Bide batez, diesel motorren eraginkortasuna gasolina erabiltzen dutenena baino altuagoa denez, CO2-ren isurketak murrizteko aukera ere eskaintzen du.
Gainera, hondakin bezala ekoitzitako CO2, DME ekoizteko lehengai gisa erabiltzeko ahaleginak egiten ari dira. Hala, klima-aldaketarako hain kaltegarria den konposatua, erreakzio kimikoen bidez bihur daiteke, eta balio altuko konposatu kimikoa lortu.
DME ekoizteko bi estrategia daude, sintesi-gasa (hau da, karbono monoxidoaren eta hidrogenoaren nahastea) eta CO2 erabiliz: (i) bi urratsetan egindako prozesua (metanolaren sintesia katalizatzaile metalikoa erabiliz, eta ondorengo metanolaren deshidratazioa katalizatzaile azidoa erabiliz); (ii) urrats bakarrean egindako prozesua, bi funtzioak (metalikoa eta azidoa) dituen katalizatzailea erabiliz.
Etapa bakarrean egiten den DMEren sintesiak bi abantaila nagusi ditu:
- CO2 lehengai gisa erabiltzea errazten du; hori CO2 eskala handian bahitzeko lagungarria da.
- Prozesuaren etekina bi urratsetan egiten den prozesuarena baino handiagoa da.
Ikerketaren helburua
Edozein prozesu egiteko ezinbestekoa da erreaktorea diseinatzea, eta horretarako eredu zinetikoak erabiltzen dira. Eredu zinetikoek ekuazio zinetikoak (edo abiadura-ekuazioak) biltzen dituzte, erreakzio kimikoen abiadura adierazten duten ekuazioak, alegia.
Bibliografian DME urrats bakarrean ekoizteko erreaktorearen diseinua ikertu bada ere, erabili diren eredu zinetikoak metanolaren sintesi urratserako eta horren deshidratazio urratserako garatu izan dira. Lan egiteko modu horrek bi muga nagusi ditu: (i) urrats bakoitzean ezartzen diren eragiketa-baldintzak eta prozesu integratuan erabiltzen direnak ezberdinak dira; (ii) ez ditu kontuan hartzen urrats bakarrean egindako prozesuan metanola in situ eraldatzearen efektu sinergikoak.
Lan honen helburua urrats bakarrean egindako DMEren sintesi prozesurako eredu zinetiko bat garatzea da, CuO-ZnO-Al2O3/γ-Al2O3 katalizatzailea erabiliz.
Emaitza eta ondorioa
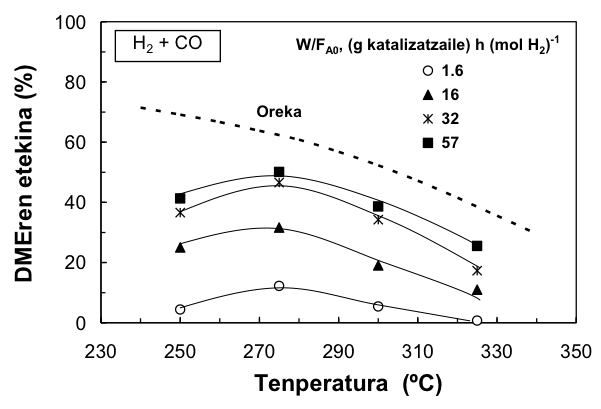
Zenbait eredu ikertu dira, eta horien artean egokiena aukeratu da, sinpletasunaren eta emaitza esperimentalak doitzearen ikuspuntutik. Garatu den eredu zinetikoak egokiro deskribatzen ditu erreakzio-inguruneko konposatuen kontzentrazioak, eragiketa-baldintzen (hala nola, tenperatura eta presioaren) tarte zabalean, eta (H2 + CO) eta (H2 + CO2) elikadurak erabiliz.
Garrantzitsua da prozesuaren hasierako uneak deskribatzen dituen eredu zinetiko sinplea lortzea, eredu hori oinarria izango baita katalizatzailearen desaktibazioa (aktibitate galera) kontuan izango duen eredu zinetiko konplexuagoa garatzeko. Azken hori erreaktorea diseinatzeko erabiliko da.
Artikuluaren fitxa
- Aldizkaria: Ekaia
- Artikuluaren izena: Dimetil eterraren sintesia CuO-ZnO-Al2O3/γ-Al2O3 katalizatzaile funtzio bikoa erabiliz. Modelakuntza zinetikoa.
- Laburpena: Lan honetan urrats bakarrean egindako dimetil eterraren (DMEren) sintesia aztertu da. Bereziki, eredu zinetiko bat proposatu da, eta parametro zinetikoak kalkulatu dira. CuO-ZnO-Al2O3/g-Al2O3 da erabilitako katalizatzailea, eta bi elikadura erabili dira: sintesi-gasa (hau da, hidrogeno eta karbono monoxidoaren nahastea) eta (H2+CO2). Eredu zinetikoak ondo doitzen ditu erreaktore finko isotermoan lorturiko emaitza esperimentalak, eragiketa-baldintzen tarte zabalean: 225-325 ºC, 10-40 bar; denbora espaziala, 1.6-57.0 (g katalizatzaile) h (mol erreakzionatzaile)-1. Modelakuntzarako erreakzio-etapa erabakigarriak honako hauek dira: metanolaren sintesia (H2+CO)-tik abiatuz – (H2+CO2)-tik egindako sintesia ez da garrantzitsua – metanolaren deshidratazioa (oso azkarra), eta lurrin/gas trukaketa (hau da, CO eta H2O-ren ar- teko erreakzioa, CO2 eta H2 emateko). Uraren efektu inhibitzailea kontuan izan da, metanolaren sintesian eta hidrokarburoen eraketan. .
- Egileak: Irene Sierra, Ainara Ateka eta Javier Ereña
- Argitaletxea: UPV/EHUko argitalpen zerbitzua
- ISSN: 0214-9001
- Orrialdeak: 181-192
Egileez: Irene Sierra, Ainara Ateka eta Javier Ereña UPV/EHUko Ingeniaritza Kimikoa Saileko ikertzaileak dira.
—————————————————–
Ekaia aldizkariarekin lankidetzan egindako atala.