Gaixotasun askok jatorri genetikoa izanik, DNA edo RNA mailan gertatzen diren akatsen edo mutazioen ondorioz, bizidunek ez dute fisiologikoki beharrezko den proteina sortzen edo sortzen duten proteina ez da funtzionala izaten. Terapia genikoek gaixotasuna eragiten duen arazoa errotik konpontzea dute helburu, sintetizatzen ez den proteina sortzea alegia.

Badira urte batzuk terapia genikoek ez dutela izan esperoko arrakasta, baina une honetan bioteknologiak eta ingeniaritza genetikoak egin dituzten aurrerapausoak direla eta, berpiztu egin da terapia mota honekiko interesa. Teknika hauek, besteak beste, badute eragozpen bat gaixotasuna sendatuko lukeen genearen cDNAren tamainan, ez baitzegoen neurri handiko gene-transferentzia egiteko gaitasuna zuen bektorerik.
Gaur egun ordea hainbat teknikaren bidez saiatu dira arazo hau gainditzen; hori dela eta terapia genikoan aurrerapauso garrantzitsua eman da, zientzia eta bioteknologian erabilgarri izango diren baliabideei harrera emanaz.
Badira genomaren zuzenketa egiten duten teknologia ugari eta horretarako endonukleasek erabilpen zabala dute egunotan. Hedatuena, CRISPR/Cas9 (Clustered regularly interspaced short palindromic repeats CRISPR associated 9 (Cas9)) sistema da bere efikazia eta bertsatilitateagatik. Bere eraginkortasunagatik eta bere erabilera anitzengatik, CRISPR/Cas9 da sistema hedatuena.
Cas9 bakterioek kanpo DNA degradatzeko erabiltzen duten proteina bat da. Teknologia hau edozein zelula aldatu eta zuzentzeko erabiltzen da. Oso zehatzak izango liratekeen guraize molekular hauek edozein DNA molekula moztu eta bertan DNA berri bat gehitzeko gaitasuna dutenak. Behaturiko erronkarik handiena, beharrezkoa den entzima eta RNA gida, itua den ehunera zuzentzeko modua da.
Baina teknologia honetan ez dugu sakonduko RNAren heltze prozesuko terapiari buruzko estrategietara mugatuko baikara.
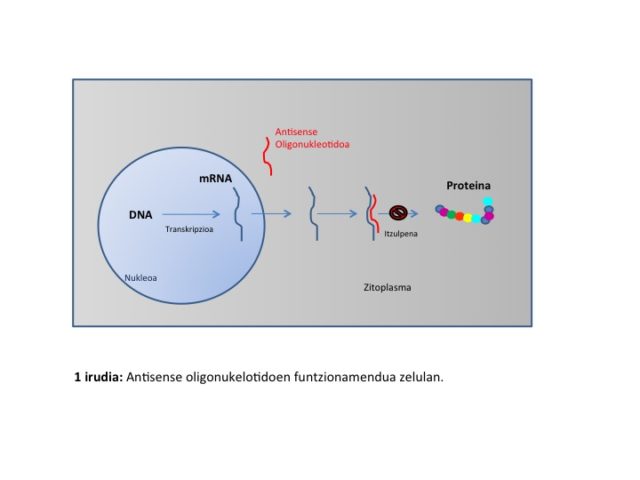
Gene jakin bat adierazia izan dadin, transkripzio prozesuaren ondorioz mRNA sortuko da informazio genetikoaren transmisioa baimentzeko. Besteak beste, jatorri genetikoa duten gaixotasun askoren artean badira, RNA mezulariaren heltze-prozesuan gertatzen diren akatsek sortzen dituzten gaixotasunak. Esan bezala, RNAn oinarrituriko terapiek mutazioa daramaten geneen adierazpena erregulatzea dute helburu. Akats mota jakin honi irtenbide bat emateko, gaur egun splicingean oinarrituriko hiru estrategia dira erabilienak:
Antisense Oligonukleotidoak (ASO): Antisense
Oligonukleotidoak orokorrean 13-25 nukleotido dituen azido nukleikoak dira, zeintzuk gene zehatz baten sekuentziarekiko osagarri diren. Hauek, zelulako mRNAri atxikituz proteinaren sintesia ekidin edo sintesian eraldaketak eragiten dira; horrela ordezko splicing bat bultzatzen dute lorturiko proteinak desiotako egitura izango duelarik (1 eta 2 irudia).
Oligonukelotido arrotzak zelulan sartuz gero, nukleasek azkar degradatzen dituzte, eta beraz, berauek aldaketa kimikoak behar dituzte degradazio hau ekiditeko. Aldaketa erabilienak 2’-gluzidoaren aldaketak dira, fosforilazioak, metilazioak, eta abar, horrela lotze-afinitatea eta farmakozinetika asko hobetzen delarik (Goyenvalle et al 2016).
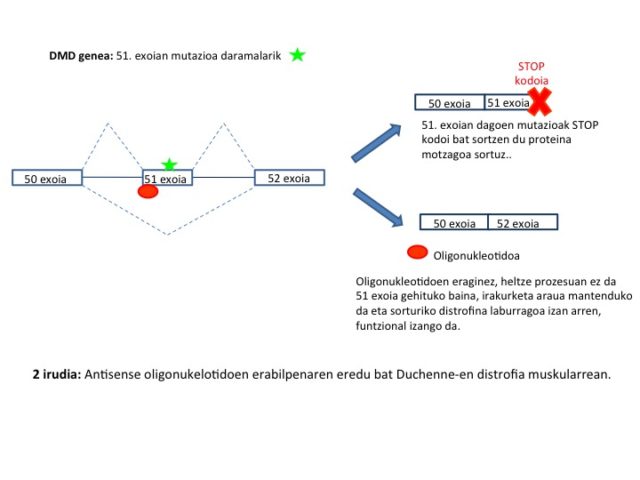
Oligonukleotidoetan oinarrituriko terapiak etorkizun handikoak dira monogenikoak diren zenbait gaixotasunen splicing patologikoa zuzentzeko. Hauen eredu adierazgarriena Duchennen distrofia muskularrean erabilitako estrategia da. Estrategia honetan, mutazioa daraman exoia splicing bidez kentzen da (exon skipping) eta lorturiko proteina txikiagoa izan arren funtzioa bete dezake (2 irudia). Entsegu klinikoak urrats aurreratuetan daude dagoeneko, Duchenneen muskulu-distrofia eta muskulu-atrofiarako aplikazioetarako. Dena den, FDAk (US Food and Drug Administration) ez du dagoeneko oligonukleotidoetan oinarrituriko terapiarik baimendu minbiziaren tratamendurako (Lee et al 2016).
Splicing modulatzaileak
Splicing-akatsak zuzentzeko gero eta gehiago erabiltzen dira molekula txikiak, zeluletan oligonukelotidoak baino errazago barneratzen direnak. Molekula txiki hauek, splicing modulatzaile deiturikoak, splicinga egiten duen zelula-makineriari eragiten diote, izan ere molekula hauek ez dute akasdun exoia itutzat hartzen (Chakradhar et al 2016).
Molekula hauek spliceosomako proteina ezberdinak izan ditzakete itutzat, splicinga gertatzeko beharrezko diren konplexuen sorrera ekiditen delarik.
Konpainia farmazeutikoak oraindik hauen eragiteko modua aztertzen ari badira ere, spliceosomari zuzenean atxikitzen zaizkiola uste da.
Badira dagoeneko, ahoz har daitezkeen bi hautagai, RG7800 eta RG7916 farmakoak alegia; hauek, gaixoentzat askoz egokiago izanik SMA atrofia espinalerako erabiltzen dira. Badirudi, RG7800rekin arazoren bat egon zela baina RG7916k, SMN2 genearen mRNA kopurua handitzen du odolean eta 1 fase klinikoan dago. Badira minbizi arloan erabilitako beste zenbait molekula ere. (Chakradhar et al 2016)
Aipaturiko bi estrategia hauetan ere erronkak badira, espezifizitatea eta banaketari dagozkionak alegia. Alde batetik, molekula txiki modulatzaile hauek, splicing makineriarengan eragiten dute eta ezespezifikoak izanik, itutik kanpo eraginda albo efektuak sor ditzakete. Bestalde, gorputzeko entzimek oligonukleotidoak molekula modulatzaileak baino errazago degradatzen dituzte eta oligonukleotidoak zeluletan barneratzeko ere zailagoak dira. Gainera, zaila da oligonukleotido hauek splicing makinarian eragiteko nukleoan sartzeko gaitasuna dutela ziurtatzea. Horretaz gain oligonukleotido bakoitzak oro har, mutazio bat zuzentzen du eta beraz, oligonukleotido asko beharko genituzke gaixotasun bakar bat sendatzeko.
Arazo hauek direla eta, zientzialari batzuen iritziz teknologia hauek baina hobea izan daiteke RNA bidezko trans-splicinga (Berger et al 2016).
RNA bidezko trans-splicinga edo SMaRT (Spliceosome-mediated RNA trans-splicing
RNA bidezko trans-splicinga edo SMaRT izendaturiko estrategia, terapia geniko berritzaileak diseinatzeko etorkizun handiko estrategia da, tratamendurik ez duten gaixotasunentzat.
SMaRT teknologiak, mutazioen zuzenketa-transkripzioaren ondoren egiten du eta ondorioz mRNA sekuentzia aldatzen du. Horretarako, exogenoa den RNA bat barneratzen da zelula ituan eta splicinga gertatzen da RNA exogeno horren eta itua den pre-mRNA endogenoaren artean. Beraz, heltze prozesua trans moduan gertatzen da (3 irudia).
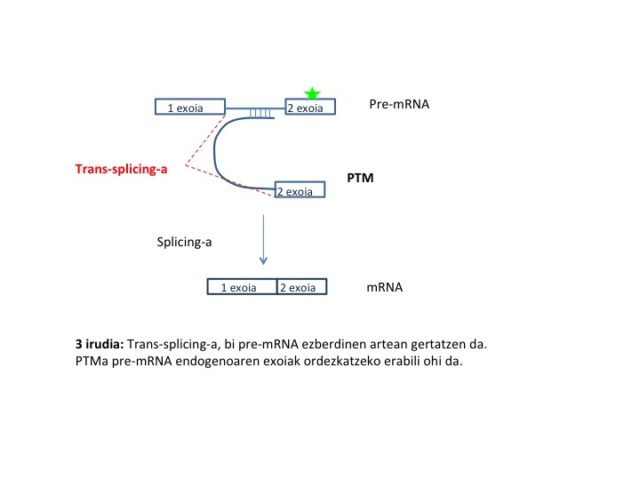
Trans-splicinga arrunta izan arren, tripanosoma eta nematodoetan, gertaera nahiko arraroa da ugaztunetan banandurik dauden bi premRNA-ren artean mRNA kimeriko bat osatzea. Dena dela, RNAren splicingeko makinaria naturalaz eta mekanismo honek dakartzan abantailaz baliatzeak, RNAren terapien aplikaziorako abangoardiara ekarri du SMaRT teknologiak.
Terapia genikoan erabil ahal izateko, pre-mRNA trans-splicing molekulak –PTM (pre-mRNA trans-splicing molecule) – deiturikoak erakusten dituen ezaugarriengatik, trans-splicingak dituen abantailak ondokoak dira:
1- Itua lehen introia denean, eta ondorengo sekuentzia guztia ordezkatzen denean, PTM bakarra behar da ondoren egon daitezkeen mutazio ugari konpondu ahal izateko. Honek CRISPR teknologia, ASO edo beste molekula batzuk baina abantaila gehiago ditu, azken hauek mutazio zehatz bakarra izan dezaketelako itutzat.
2- Gene desberdinen erregulazioa, espazio eta denboran, oso zorrotza izan behar da zelulen oreka fisiologikoa manten dadin. Beraz, PTMak, trans-splicing prozesurako izan ezik, inerteak direnez, berauen adierazpena erabat naturala den pre-mRNA ituaren erregulazioaren menpekoa da.
3- PTMek gaitasun bikoitza azaltzen dute erreakzio bakar batean, mutaturiko proteinaren sintesia murriztekoa eta halaber, proteina normalaren sintesia sustatzekoa alegia.
4- PTMak konponketarako cDNAren atal batez soilik osaturik daudenez (beste terapia genikoek cDNA osoaren premia dute), tamaina txikiko molekula baten beharra besterik ez dago. Horrela bektore gisa erabiltzen diren birusen eskaintza zabalagoa izatea baimentzen da.
Badira oraindik tras-splicingari buruz ezagutzen ez diren zenbait arlo; cis-splicingari buruzko informazio asko daukagun baina tras-splicingari buruzkoa ez da hain ugaria eta gaur egun ezinezkoa da PTMak izango duen eraginkortasuna aldez aurretik jakitea.
Trans-splicing teknologia gaixotasun askoren terapiarako erabili da dagoeneko, hala nola, distrofia muskularretan (Duchenne-en distrofia muskularra, Disferlinopatiak, Titinopatiak), Retinosi pigmanetarian, Fibrosi kistikoan,… Hauetaz gain ere zenbait minbiziren tratamendurako erabili izan da splicingaren zuzenketa.
Hala ere zoritxarrez, trans-splicinga ez da oraindik gehiegi garatu gaur egun eta oraindik hobeto aztertu eta ulertu behar da, PTM indartsuagoak lor ahal izateko.
Zenbait saiakera egin dira aipaturiko gaixotasunetan, baina oraingoz efizientzia ez da espero zitekeena bezain ona eta teknologia honen bidez ez da gaixotasuna gainditzeko proteina kopuru adina sortzen.
Sekuentziaren espezifikotasuna litzateke ordea arazo larriena, ingeniaritza genetikoko erreminta guztien kasuan gertatzen den bezala. Izan ere, ez genuke nahi trans-splicinga proteina aberrante baten sortzaile izatea.
Bestalde PTMaren gehiegizko adierazpenak ere arazoak sor ditzake, inespezifitatea gehitu edo toxikoa den gehiegizko RNA txikiaren gainadierazpena gerta baitaiteke.
Besteak beste, beharrezko ezagutza lortuta, efizientzia %100 izanda, eta albo ondorioak ekidinda, SMaRT teknologia benetan eraginkor eta boteretsu den terapia genikorako tresna izango da etorkizunean, gaixotasun askoren sendabide izanik.
Egileaz: Amets Sáenz Peña Biodonostia Osasun Ikerketa Institutuko ikertzailea da eta egun, Gaixotasun Neuromuskularren Taldean dihardu lanean.